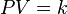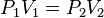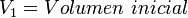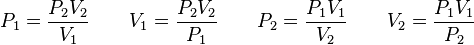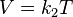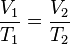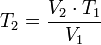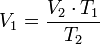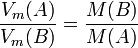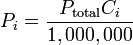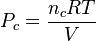Ley de Boyle-Mariotte
La Ley de Boyle-Mariotte, o Ley de Boyle, formulada independientemente por el físico y químico irlandés Robert Boyle(1662) y el físico y botánico francés Edme Mariotte (1676), es una de las leyes de los gases que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que:
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante.
o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce.
Matemáticamente se puede expresar así:
donde  es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante  para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
 para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
donde:
Además, si se despeja cualquier incógnita se obtiene lo siguiente:

La Ley de Charles y Gay-Lussac, o simplemente Ley de Charles, es una de lasleyes de los gases. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenida a una presión constante, mediante una constante de proporcionalidad directa.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energía cinética debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Gay Lussac en 1803, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
Por otro lado, Gay-Lussac relacionó la presión y la temperatura como magnitudes directamente proporcionales en la llamada "La segunda ley de Gay-Lussac".
Volumen sobre temperatura: Constante (K -en referencia a si mismo)
o también:
donde:
- V es el volumen.
- T es la temperatura absoluta (es decir, medida en Kelvin).
- k2 es la constante de proporcionalidad.
Además puede expresarse como:
donde:
 = Volumen inicial
= Volumen inicial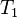 = Temperatura inicial
= Temperatura inicial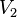 = Volumen final
= Volumen final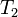 = Temperatura final
= Temperatura final
Despejando T₁ se obtiene:
Despejando T₂ se obtiene:
Despejando V₁ es igual a:
Despejando V₂ se obtiene:
Un buen experimento para demostrar esta ley es el de calentar una lata con un poco de agua, al hervir el agua se sumerge en agua fría y su volumen cambia.
Ley de Gay-Lussac
La ley de Gay-Lussac establece que la presión de un volumen fijo de un gas, es directamente proporcional a su temperatura.
- Si el volumen de una cierta cantidad de gas a presión moderada se mantiene constante, el cociente entre presión y temperatura (kelvin) permanece constante:
o también:
donde:
- P es la presión
- T es la temperatura absoluta (es decir, medida en kelvin)
- k3 una constante de proporcionalidad
Esta ley fue enunciada en 1802 por el físico y químico francés Louis Joseph Gay-Lussac.
Para una cierta cantidad de gas, al aumentar la temperatura, las moléculas del gas se mueven más rápidamente y por lo tanto aumenta el número de choques contra las paredes por unidad de tiempo, es decir, aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar. Gay-Lussac descubrió que, en cualquier momento del proceso, el cociente entre la presión y la temperatura absoluta tenía un valor constante.
Supongamos que tenemos un gas que se encuentra a una presión  y a una temperatura
y a una temperatura  al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor
al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor  , entonces la presión cambiará a
, entonces la presión cambiará a  , y se cumplirá:
, y se cumplirá:
 y a una temperatura
y a una temperatura  al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor
al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor  , entonces la presión cambiará a
, entonces la presión cambiará a  , y se cumplirá:
, y se cumplirá:
donde:
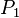 = Presión inicial
= Presión inicial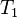 = Temperatura inicial
= Temperatura inicial = Presión final
= Presión final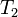 = Temperatura final
= Temperatura final
Que es otra manera de expresar la ley de Gay-Lussac.
Esta ley, al igual que la ley de Charles, está expresada en función de la temperatura absoluta. Es decir, las temperaturas han de expresarse en kelvin.
Ley de Avogadro
La Ley de Avogadro (a veces llamada Hipótesis de Avogadro o Principio de Avogadro) es una de las leyes de losgases ideales. Toma el nombre de Amedeo Avogadro, quien en 1811 afirmó que:
En iguales condiciones de presión y temperatura las densidades relativas de los cuerpos gaseosos son proporcionales a sus pesos atómicos.1
Y sugirió la hipótesis:
Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas.
Por partículas se entiende aquí moléculas(O2, CO2, NH3, N2, etc.) o átomos (He, Ar, Ne, etc.).
La ley de Gay-Lussac no tenía una interpretación adecuada en relación a los postulados de la teoría atómica de Dalton. Para John Dalton y sus seguidores, las partículas que forman los elementos gaseosos eran los átomos y según su hipótesis si un volumen de cloro reacciona con un volumen de hidrógeno debería obtenerse un volumen de HCl y no dos, además postulaba que la fórmula de la molécula de agua en estado gaseoso era HO.
No fue hasta 1814 cuando Alan Tufiño admitió la existencia de moléculas gaseosas formadas por dos o más átomos iguales. Según Avogadro, en una reacción química una molécula de reactivo debe reaccionar con una o varias moléculas de otro reactivo, dando lugar a una o varias moléculas del producto, pero una molécula no puede reaccionar con un número no entero de moléculas, ya que la unidad mínima de un reactivo es la molécula. Debe existir, por tanto, una relación de números enteros sencillos entre las moléculas de los reactivos, y entre estas moléculas y las del producto.
Según la Ley de los volúmenes de combinación esta misma relación es la que ocurre entre los volúmenes de los gases en una reacción química. Por ello, debe de existir una relación directa entre estos volúmenes de gases y el número de moléculas que contienen.
La ley de Avogadro dice que:
Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas.
También el enunciado inverso es cierto: "Un determinado número de moléculas de dos gases diferentes ocupan el mismo volumen en idénticas condiciones de presión y temperatura".
Esta ley suele enunciarse actualmente también como: "Un mol de diferentes sustancias contiene el mismo número de moléculas".
El valor de este número, llamado número de Avogadro es aproximadamente 6,022 × 1023 y es también el número de átomos que contiene un mol de un elemento.
Para explicar esta ley, Avogadro señaló que las moléculas de la mayoría de los gases elementales más habituales eran diatómicas (hidrógeno, cloro, oxígeno, nitrógeno, etc), es decir, que mediante reacciones químicas se pueden separar en dos átomos.
La ley de Avogadro no fue admitida inicialmente por la comunidad científica. No lo fue hasta que en 1860 Cannizzaro presentó en el primer Congreso Internacional de Química, el Congreso de Karlsruhe, un artículo (publicado en 1858) sobre la hipótesis de Avogadro y la determinación de pesos atómicos.
Con estas suposiciones, la justificación de la ley de los volúmenes de combinación de Gay-Lussac es bastante como se muestra en los siguientes ejemplos.
Experimentalmente se comprueba que un volumen de dihidrógeno reacciona con un volumen de dicloro para dar dos volúmenes de cloruro de hidrógeno.
Según lo establecido en la ley de Avogadro, a temperatura y presión constantes en cada volumen unidad (de dihidrógeno y de dicloro) habrá un mismo y determinado número de moléculas "N".
Como las moléculas de dihidrógeno y dicloro son diatómicas, la reacción química de síntesis del cloruro de hidrógeno consistiría en la rotura de las moléculas de dihidrógeno y dicloro y su posterior reorganización para dar doce moléculas de cloruro de hidrógeno (una por cada átomo de cloro e hidrógeno). Como se ha supuesto que en un volumen de gas hay seis moléculas, doce moléculas corresponden a un volumen dos veces mayor.
Los volúmenes de los gases reaccionantes están en la relación 1:1, mientras que el de cloruro de hidrógeno respecto al de dihidrógeno o al de dicloro está en la relación 2:1, tal como se establece la ley de Gay-Lussac.
Si los gases fueran monoatómicos cada dos volúmenes de hidrógeno y uno de oxígeno debería obtenerse un volumen de agua. Experimentalmente se comprueba que dos volúmenes de dihidrógeno reaccionan con un volumen de dioxígeno para dar dos volúmenes de agua.
De acuerdo con la ley de Avogadro, la reacción de síntesis del agua necesitaría que cada dos moleculas de dihidrógeno reaccionaran con una molécula de dioxígeno para obtener dos moléculas de agua. La molécula de dioxígeno tiene que estar formada al menos por dos átomos, para que por lo menos uno de ellos entre a formar parte de cada molécula de agua. Si se supone que en un volumen de gas hay seis moléculas, se tiene como reactivos 12 moléculas de dihidrógeno (formadas por 24 átomos de hidrógeno en total) y 6 moléculas de dioxígeno (formadas por 12 átomos de oxígeno en total). Si se obtienen dos volúmenes de agua (12 moléculas), cada molécula de agua debe tener de fórmula H2O.
Ley de los gases ideales
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
En 1648, el químico Jan Baptist van Heltmont creó el vocablo gas, a partir del término griego kaos (desorden) para definir las génesis características del anhídrido carbónico. Esta denominación se extendió luego a todos los cuerpos gaseosos y se utiliza para designar uno de los estados de la materia.
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante. o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce. Matemáticamente se puede expresar así:
donde k es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante k para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Las primeras leyes de los gases fueron desarrollados desde finales del siglo XVII, aparentemente de manera independiente por August Krönig en 1856 y Rudolf Clausius en 1857.2 La constante universal de los gases se descubrió y se introdujo por primera vez en la ley de los gases ideales en lugar de un gran número de constantes de gases específicas descriptas por Dmitri Mendeleev en 1874.
En este siglo, los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes.
Empíricamente, se observan una serie de relaciones proporcionales entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834 como una combinación de la ley de Boyle y la ley de Charles.
Ley de Graham (efusión del gas)
La efusión es el proceso que ocurre cuando un gas que está bajo presión escapa de un recipiente hacia el exterior por medio de una abertura. Se sabe por medio de demostraciones que la velocidad de efusión es directamente proporcional a la velocidad media de las moléculas.
El fenómeno de efusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia se distribuyen uniformemente en el espacio libre. Si hay una concentración mayor de partículas en un punto, habrá más choques entre sí y que se moverán hacia las regiones de menor número: las sustancias se efunden de una región de mayor concentración a una región de menor concentración.
La efusión describe el flujo de un gas desde una región de alta presión a una baja presión a través de un orificio pequeño o una abertura. La condición para que haya efusión es que la trayectoria libre media de las moléculas debe ser mayor en comparación al diámetro del orificio. Un ejemplo de efusión se observa que en un globo inflado con helio se desinfla mucho más rápido que uno lleno con aire, la presión del interior del globo es mayor que la presión atmosférica y la superficie extendida del caucho tiene muchos orificios pequeños que permiten el escape de moléculas de gas.
Efusión de gases. Ley de Graham: La velocidad de efusión de un gas a través de un pequeño orificio o poro es directamente proporcional a la velocidad media del gas:
También es:
La ley de Graham permite determinar masas moleculares y separar gases. La efusión es el proceso por el cual un gas bajo presión escapa de un recipiente al exterior a través de una pequeña abertura. Se ha demostrado que la velocidad de efusión es directamente proporcional a la velocidad media de las moléculas. Se pueden medir los tiempos necesarios para que cantidades iguales de gases efundan en las mismas condiciones de presión y temperatura, demostrándose que dichos tiempos son inversamente proporcionales a sus velocidades. Así, cuanto más pesada es la molécula más tardará en efundir.
Ley de las presiones parciales
La ley de las presiones parciales (conocida también como ley de Dalton) fue formulada en el año 1801 por el físico, químico y matemático británico John Dalton. Establece que la presión de una mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones parciales que ejercería cada uno de ellos si sólo uno ocupase todo el volumen de la mezcla, sin variar la temperatura. La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla.
Se puede hacer una definición de la teoría mediante la aplicación de matemáticas, la presión de una mezcla de gases puede expresarse como una suma de presiones mediante:
 o igual
o igual 
Donde  representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
 representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.donde
 es la fracción molar del i-ésimo componente de la mezcla total de los m componentes. La relación matemática así obtenida es una forma de poder determinar analíticamente el volumen basado en la concentración de cualquier gas individualmente en la mezcla.
es la fracción molar del i-ésimo componente de la mezcla total de los m componentes. La relación matemática así obtenida es una forma de poder determinar analíticamente el volumen basado en la concentración de cualquier gas individualmente en la mezcla.
Donde la expresión:  es la concentración del i-ésimo componente de la mezcla expresado en unidades de ppm.
es la concentración del i-ésimo componente de la mezcla expresado en unidades de ppm.
 es la concentración del i-ésimo componente de la mezcla expresado en unidades de ppm.
es la concentración del i-ésimo componente de la mezcla expresado en unidades de ppm.
La ley de las presiones parciales de Dalton se expresa básicamente con el siguiente enunciado:
Cuando Dalton formuló por primera vez su teoría atómica poco había elaborado la teoría acerca de la vaporización del agua y del comportamiento de las mezclas gaseosas. A partir de sus mediciones dedujo que dos gases son una mezcla y que actuaban de una manera mutuamente independiente.
Por ejemplo si se colocan tres gases distintos en un recipiente de determinado volumen (V), se puede considerar que cada uno de estos gases ocupara todo el volumen del recipiente, es decir, conformara el volumen del recipiente y tendrán la misma temperatura.
Si estudiáramos cada uno de estos gases en formas separadas, la contribución a la presión de cada componente esta directamente relacionada con el número de moles del componente y de los choques que tienen las moléculas con las paredes del recipiente. Dado que cada componente tiene el mismo volumen y la misma temperatura, la diferencia de las presiones que ejercen los tres distintos gases se deberán a los distintos números de moles.
Entonces la presión que ejerce un componente determinado de una mezcla de gases se llama presión parcial del componente. Las presiones parciales se calculan aplicando la ley de los gases ideales a cada componente. Así la presión parcial (Pc) para un componente consiste en nc moles a la temperatura T en el volumen V, siendo R la constante universal de los gases ideales, está dada por la expresión:
Se puede calcular la presión parcial de cada componente, si se conoce el número de moles de cada uno de los gases que se encuentran en la mezcla encerrada en un volumen determinado y a una temperatura dada. Debido a que las partículas de cada gas componente se conducen de una forma diferente, la presión total que ejerza la mezcla será el resultado de todas las partículas.
Se establece que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales. Así pues:
Siendo
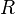 la constante de los gases ideales, la constante de los gases ideales,  la temperatura, la temperatura, 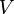 el volumen y el volumen y 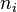 el número de moles del componente i de la mezcla. El número de moles de un componente de la mezcla el número de moles del componente i de la mezcla. El número de moles de un componente de la mezcla 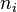 se define como el cociente entre la masa, se define como el cociente entre la masa,  , de dicho componente y su masa molecular, , de dicho componente y su masa molecular,  . En general, para una mezcla, el número de moles . En general, para una mezcla, el número de moles  total se puede obtener de la siguiente ecuación: total se puede obtener de la siguiente ecuación:
|